Como Calcular ppm (parte por milhão) Fácil [Vídeo]

Nesse post você saberá como calcular ppm (partes por milhão), de soluções usando uma regra de três, da Matemática, de forma muito simples e fácil.
Algumas soluções (soluto + solvente) apresentam quantidades de solutos, ou componentes pertencentes a uma determinada amostra, em quantidades muito pequenas. Dessa forma essas concentrações são medidas em ppm ou partes por milhão. Podemos encontrar essas medições nas provas de Química no capítulo de Soluções, mas em raras ocasiões também poderá aparecer na prova de matemática, por ter seu desenvolvimento a partir de uma regra de três simples.
Partes por milhão (ppm) indica a quantidade, em gramas, de soluto presente em 1 milhão (1.000.000) de gramas da solução. É uma grandeza que serve para relacionar a massa do soluto com a de soluções que estão muito diluídas.
Um exemplo do nosso cotidiano é o teor de enxofre do diesel. Ele deve ser de 50 ppm de acordo com a resolução do CONAMA. Mas o que isso significa?
Se temos 50 ppm de enxofre no diesel, isso significa que temos 50 g de enxofre para cada um milhão de g de diesel.

Outro exemplo muito importante no nosso cotidiano é a concentração de CO2 na atmosfera.
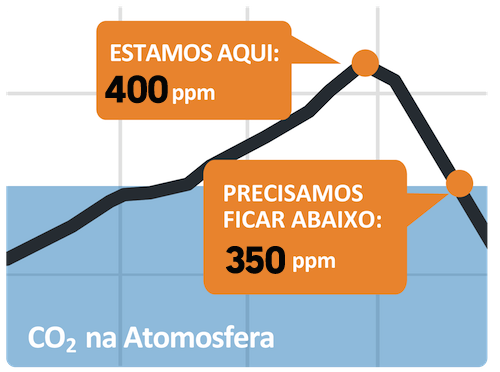
Segundo a Organização das Nações Unidas (ONU), precisamos manter um limite mínimo para a concentração de gás carbônico de 350 ppm. Valores superiores a esse corremos o risco de termos um aumento de temperatura média no planeta entre 2 0C a 2,4 0C.
Os últimos valores calculados pela ONU, mostraram que temos 400 ppm e o limite, tido como máximo do ideal, calculado por eles é de 350 ppm.
1) A embalagem de um creme dental especifica 1500 ppm de flúor. A mesma possui 120 mg. Qual a quantidade de Flúor em gramas, nessa amostra?
2) 100 ml de água contém 20 ppm de Chumbo (Pb).
Quantos miligramas (mg) de Pb está contido nessa amostra?
Resoluções
Questão 1)
Dados: Amostra de creme dental com 120 g e 1500 ppm de Flúor.
1500 g ————- 1.000.000 g
x ————— 120 g
x =(120 . 1500)/1.000.000 = 0,18 g ou 180 mg
Questão 2)
Dados: Amostra contém 100 ml de água. Note que como a densidade da água é 1, temos a proporção de 1:1 na relação massa/volume, ou seja 1 ml de água = 1 g de água
Temos então 100 g de água na amostra e 20 ppm de Chumbo (Pb).
20 g ———– 1.000.000 g
x ———— 100 g
x = 100.20/1.000.000 = 2.10-3 g = 2 mg




.jpg)